Sebelum kita masuk ke pembahasan
tentang mekanisme reaksi substitusi nukleofilik SN2, saya akan membahas sedikit
tentang sejarah dari penemuan reaksi substitusi nukleofilik.
Sejarah Penemuan Reaksi Substitusi Nukleofilik
Reaksi
SN2 menyebabkan inversi konfigurasi stereokimia, yang dikenal
sebagai inversi Walden. Inversi Walden adalah inversi pusat kiral dalam molekul
dalam suatu reaksi kimia. Karena sebuah molekul dapat membentuk dua enansiomer
di sekitar pusat kiral, inversi Walden mengubah konfigurasi molekul dari satu
bentuk enansiomer ke yang lainnya. Misalnya, dalam reaksi SN2, inversi
Walden terjadi pada atom karbon tetrahedral. Itu dapat divisualisasikan dengan
membayangkan sebuah payung yang dibalikkan keluar dalam badai. Dalam inversi
Walden, serangan bagian belakang oleh nukleofil dalam reaksi SN2 menimbulkan
produk yang konfigurasinya berlawanan dengan reaktan. Oleh karena itu, selama
reaksi SN2, 100% inversi produk terjadi. Ini dikenal sebagai inversi
Walden.
Inversi
ini pertama kali diamati oleh ahli kimia yaitu Paul Walden pada tahun 1896. Dia mampu mengubah satu enansiomer dari senyawa kimia menjadi enansiomer lainnya
dan kembali lagi dalam siklus Walden yang disebut seperti ini: (+) asam
klorosuksinat (1 dalam skema 1) diubah menjadi (+) asam malat 2 melalui aksi
perak oksida dalam air dengan retensi konfigurasi, pada langkah berikutnya
gugus hidroksil digantikan oleh klorin ke isomer lain asam klorosuksinat 3
melalui reaksi dengan fosfor pentaklorida, sedetik reaksi dengan perak oksida
menghasilkan (-) asam malat 4 dan akhirnya reaksi kedua dengan PCl5
mengembalikan siklus ke titik awal.
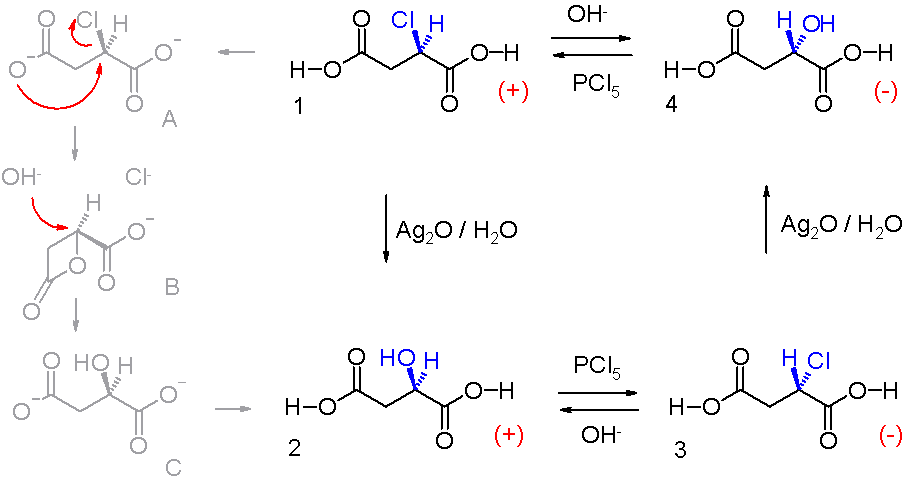
Dalam
reaksi ini oksida perak pada langkah pertama bertindak sebagai donor hidroksida
dan ion perak bereaksi dengan hidrogen yang dilepaskan untuk mengeluarkannya
dari larutan, membuat reaksi tersebut pada dasarnya dapat dibalik. Zat antara karboksil dianion A yang memberikan substitusi nukleofilik intramolekul
untuk cincin β-lakton beranggotakan empat. Kelompok karboksil lainnya juga reaktif
tetapi dalam data silico menunjukkan bahwa keadaan transisi untuk pembentukan
α- beranggota lima lakton yang sangat tinggi. Cincin ion hidroksil membuka
kembali lakton ke alkohol C dan efek bersih dari dua jumlah inversi adalah
retensi konfigurasi.
Reaksi
Substitusi Nukleofilik
Selanjutnya setelah membahas tentang sejarah dari penemuan reaksi substitusi nukleofilik, kita akan membahas mengenai reaksi Substitusi Nukleofilik SN2. Berdasarkan pereaksi yang digunakan, reaksi subsitusi itu sendiri terbagi menjadi 3 tipe yaitu : reaksi substitusi radikal bebas, reaksi subsitusi
Nukleofilik dan reaksi subsitusi elektrofilik. Namun pada postingan ini akan
membahas mengenai reaksi Subsitusi Nukleofilik. Pada
dasarnya yang dimaksud dengan reaksi Subsitusi adalah suatu reaksi terjadi apabila sebuah atom atau gugus yang
berasal dari pereaksi menggantikan sebuah atom atau gugus dari molekul yang
bereaksi. Reaksi substitusi dapat terjadi pada atom karbon jenuh atau tak
jenuh. Sedangkan yang dimaksud dengan reaksi Subsitusi Nukleofilik adalah
Reaksi Subsitusi Nukleofilik terjadi apabila atom/gugus yang diganti mempunyai
elektronegativitas lebih besar dari atom C, dan atom/gugus pengganti adalah suatu
nukleofil, baik nukleofil netral atau nukleofil yang bermuatan negatif.
Reaksi Subsitusi Nukleofilik merupakan suatu reaksi dimana satu atom, ion atau gugus molekul organic disubsitusikan (digantikan) dengan suatu Nukleofil. Adapun factor-faktor yang mempengaruhi reaksi Subsitusi sama halnya dengan reaksi eliminasi antara lain: struktur alkilhalida, leaving group X-, dan nukleofilik atau basa (Pudjamoko, 1996 : 99).

Gambar di atas merupakan rumus umum dari substitusi nukleofilik.
Adapun contoh dari masing-masing reaksinya adalah sebagai berikut:

Mekanisme
Substitusi Nukleofilik SN2
Pada
gambar diatas terlihat jelas bahwasannya Nukleofil menyerang dari belakang
ikatan C-X. Pada keadaan transisi, nukleofil dan gugus pergi berasosiasi dengan
karbon di mana substitusi akan terjadi. Pada saat gugus pergi terlepas dengan
membawa pasangan elektron, nukleofil memberikan pasangan elektronnya untuk
dijadikan pasangan elektron dengan karbon. Notasi 2 menyatakan bahwa reaksi
adalah bimolekuler, yaitu nukleofil dan substrat terlibat dalam langkah penentu
kecepatan reaksi dalam mekanisme reaksi. Mekanisme reaksi SN2 hanya terjadi pada alkil halida primer dan sekunder. Nukleofil yang menyerang adalah jenis nukleofil kuat seperti -OH, -CN, -OCH3.
Berikut ini merupakan
ciri-ciri dari reaksi mekanisme SN2 adalah sebagai berikut :
- Karena Nukleofil dan substrat terlibat dalam langkah penentu kecepatan reaksi, maka kecepatan reaksi tergantung pada konsentrasi kedua spesies tersebut.
- Reaksi terjadi dengan pembalikan (inversi) konfigurasi. Misalnya jika kita mereaksikan (R)-2-bromobutana dengan natrium hidroksida menyerang dari belakang ikatan C-Br. Pada saat subsitusi terjadi, ketiga gugus yang terikat pada karbon sp3 kiral seolah-olah terdorong oleh suatu bidang datar sehingga membalik. Karena dalam molekul ini OH mempunyai prioritas yang sama dengan Br, maka hasil yang didapatkan adalah (S)-2-butanol, sehingga hasil reaksi SN2 memberikan hasil inversi.
- Jika substrat R-L bereaksi melalui mekanisme SN2, reaksi terjadi lebih cepat apabila R merupakan gugus metil atau primer, dan lambat jika R adalah gugus tersier.
Sebagai contoh reaksi SN2, penyerangan Br− (nukleofil) pada suatu etil klorida (elektrofil) menghasilkan etil bromida, dengan klorida lepas sebagai gugus pergi :

Penyerangan pada SN2 dapat terjadi jika rute sisi belakang penyerangan tidak terdapat halangan sterik oleh substituen atau substrat. Karenanya, mekanisme ini biasanya terjadi pada suatu pusat karbon primer yang tak terhalang. Jika terdapat halangan sterik pada substrat dekat gugus pergi, seperti pada pusat karbon tersier, substitusi yang terjadi lebih disukai mengikuti mekanisme SN1 dibandingkan SN2, (SN1 dapat pula disukai bila zat antara karbokation yang stabil dapat terbentuk).
Adapun beberapa faktor
yang mempengaru reaksi dari SN2, yaitu sebagai berikut :
- Kekuatan relative Nukleofil : Nukleofil yang bermuatan negatif lebih kuat dari nukleofil netral. Seperti halnya metanol akan bereaksi dengan metil iodida.
- Efek Sterik pada Nukleofil : Nukleofil dengan struktur yang lebih melimpah akan terintangi ketika membentuk ikatan tunggal.
- Gugus pergi yang baik : gugus pergi yang baik penting untuk reaksi SN1 maupun SN2.
- Efek Sterik Substrat : elektrofil yang melimpah akan menyulitkan subsitusi oleh nukleofil pada reaksi SN2.
- Manakah yang lebih baik untuk dijadikan pelarut reaksi SN2, pelarut protik polar atau pelarut aprotik polar ? Jelaskan!
- Dapatkah Anda mendeskripsikan apa itu nukleofil secara jelas dan detail dan berikan contohnya ?
- Bagaimana gugus tetangga mempengaruhi reaksi nukleofilik ?




Assalamualaikum warahmatullahi wabarakatuh
BalasHapusNama Saya liveya Parandika dengan Nim A1C117014 akan menjawab permasalahan yang ke-3. Menurut literatur yang saya baca, gugus tetangga dalam reaksi nukleofilik adalah dapat mempengaruhi kecepatan reaksi. Karena suatu gugus tetangga mempengaruhi reaksi melalui suatu jalan yang menyebabkan peningkatan kecepatan reaksi, maka gugus tetangga tersebut dikatakan sebagai “anchimeric assistance”. Peningkatan kecepatan reaksi dengan adanya partisipasi gugus tetangga diketahui dengan membandingkan laju reaksi suatu senyawa yang memiliki gugus tetangga dengan reaksi yang sama pada senyawa analog yang tidak memiliki gugus tetangga.
Terimakasih atas jawabannya, sangat membantu :)
Hapussaya MUHAMMMAD RIFKY SAIFUDDIN
BalasHapusNim : A1C117080
Saya mencoba menjawab permasalahan no.1...
Bahwa pelarut "aprotik polar" sangat mendukung mekanisme reaksi SN2. karena, pelarut aprotik memiliki ikatan dipol yang besar, sehingga dapat mempermudahkan pelarutan reaksi SN2. Contoh dari pelarut aprotik ini yaitu: Aseton (C3H6O), etil asetat (C4H8O2), diklorometan (CH2Cl2), asetonitril (C2H3N), Tetrahydrofuran (THF(C4H8O), Dimethylformamide (DMF(C3H7NO), dan Dimethyl sulfoxide (DMSO(C2H6OS).
Terimakasih atas jawabannya, sangat membantu :)
HapusSaya Winda Sitia Elisabeth Br Sinaga
BalasHapusNIM A1C117016
Saya akan mencoba menjawab permasalahan nomor 2, menurut literatur yang saya temukan Nukleofil adalah spesies yang mengandung atom yang memiliki pasangan elektron secara mandiri, nukleofil berasal dari kata nukleus dan philic (suka), merupakan spesi yang menyukai spesi bermuatan positif, pada umumnya berupa anion. Nukleofil merupakan basa Lewis yang mendonorkan pasangan elektron pada elektrofil (asam Lewis) untuk membentuk sebuah ikatan. Lawan nukleofil adalah elektrofil (penyuka electron) yang dilambangkan dengan E+, Nukleofil adalah spesies (atom / ion/ molekul) yang kaya elektron, sehingga dia tidak suka akan elektron tetapi suka akan nukleus (inti yang kekurangan elektron).
contoh nukleofil adalah BH4-, OH-,O:, dan CN-.